تکنیک ایمونوهیستوشیمی تکنیکی بسیار حساس و با جزییات زیر است. در این مقاله تلاش نموده ایم تا جزئی ترین نکات حائز اهمیت در این تکنیک که تاثیر بسزایی در نتیجه واکنش و جلوگیری از خطاهای رایج را دارد را ارائه دهیم.
فهرست مطالب
گام 1 – از نواحی با کیفیت بافت استفاده کنید
برای استفاده از بخش های نازک و مسطح که به طور کامل روی لام خشک شده اند، دقت ویژه ای داشته باشید. ترجیحاً از اسلایدهای شارژ شده یا اسلایدهای روکش دار APES برای IHC استفاده کنید.
مقاطع ناهموار بافت و با چسبندگی ضعیف، با بالا بردن امکان ایجاد رنگ در پس زمینه، لکه های غیر اختصاصی در زیر میکروسکوپ ایجاد می کنند.
بخش A: یک حباب در زیر مقطع بافت (در مرحله اتصال بافت به لام ) منجر به جدا شدن بخشی از آن در حین رنگآمیزی (لوزه، CD45) شده است.
بخش B: انتخاب ناحیه ی نامناسب و بی کیفیت از بافت و یا انجام بی کیفیت مرحله اتصال بافت به لام ،پیش از شروع واکنش ، می تواند منجر به ایجاد لکه های غیرقابل تفسیر شده است ( لوزه، CD3).
گام 2 – مرحله ی فیکس شدن بافت رول لام بسیار مهم است.
انجام با کیفیت این مرحله و رعایت انتخاب نوع تثبیت کننده، pH، دما، زمان مناسب و در شرایط ثابت در بهینه سازی جواب آزمایش تاثیر بسزایی دارد. بررسی ها نمونه ها از منظر میزان نیاز به فیکس شدن بیشتر و یا کمتر قبل پردازش بافتی بسیار مهم است.
فیکس شدن بیش از حد بافت بر روی لام و یا عدم فیکس شدن مناسب آن می تواند منجر به ایجاد نتایج متغیر گردد که در نهایت انجام واکنش و یا عیب یابی را دچار مشکل می کند.

گام 3 – از عواقب امکان اتصال بافت های مجاور آگاه باشید.
از مواد محرک چسبندگی مقطعی از بافت که بر پایه ی پروتئین هستند از جمله چسب ها، نشاسته و ژلاتین در محلول فلوتاسیون، به خصوص روی لام های شارژ شده خودداری کنید. زیرا چسب های بر پایه پروتئین می توانند سطح اسلاید باردار شده را مسدود کنند. این امر می تواند به دلیل تجمع معرف های IHC در زیر بخش های بالاتر منجر به چسبندگی ناهماهنگ و در نهایت رنگ آمیزی ناهموار گردد.
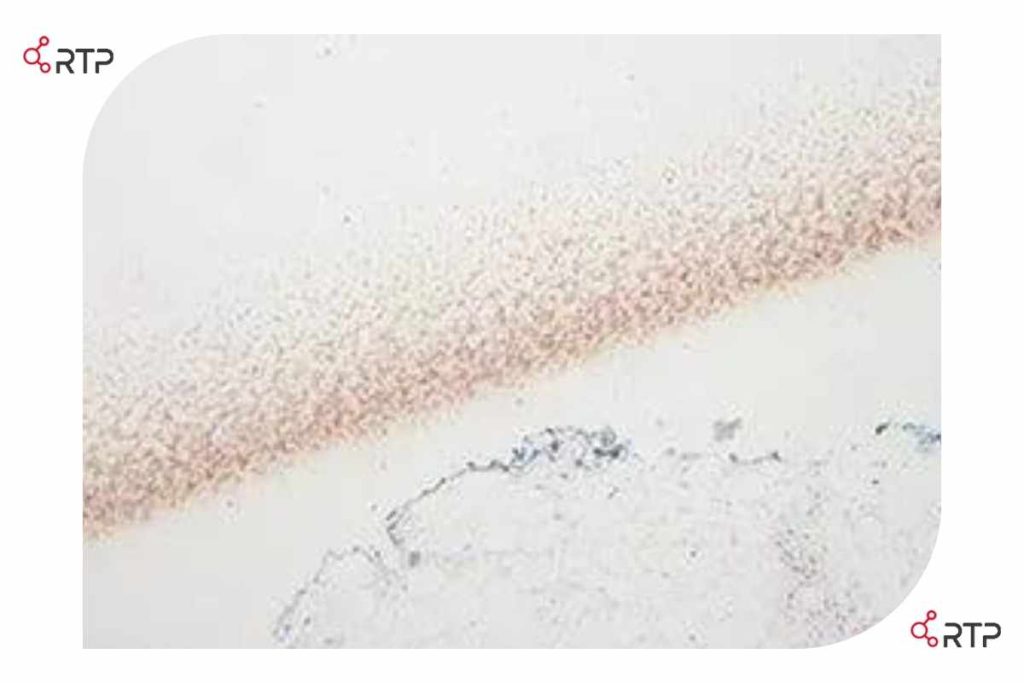
در تصویر بالا ردی از رنگ آمیزی ناحیه مجاور بافت هدف ( بافت سینه ، PR) بدلیل استفاده از محرک های چسبندگی بر پایه پروتئین مشاهده میشود
گام 4 – از ایجاد گرادیان های غلظتی خودداری کنید
با استفاده دقیق از معرف ها و رقت سازی مناسب با الکل ازایجاد گرادیان غلظت اجتناب می شود.
ایجاد گرادیان غلظتی می تواند منجر به ایجاد شیب رنگ از رنگ پذیری شدید در یک سوی بافت و لکه گیری ضعیف در سوی دیگر گردد.
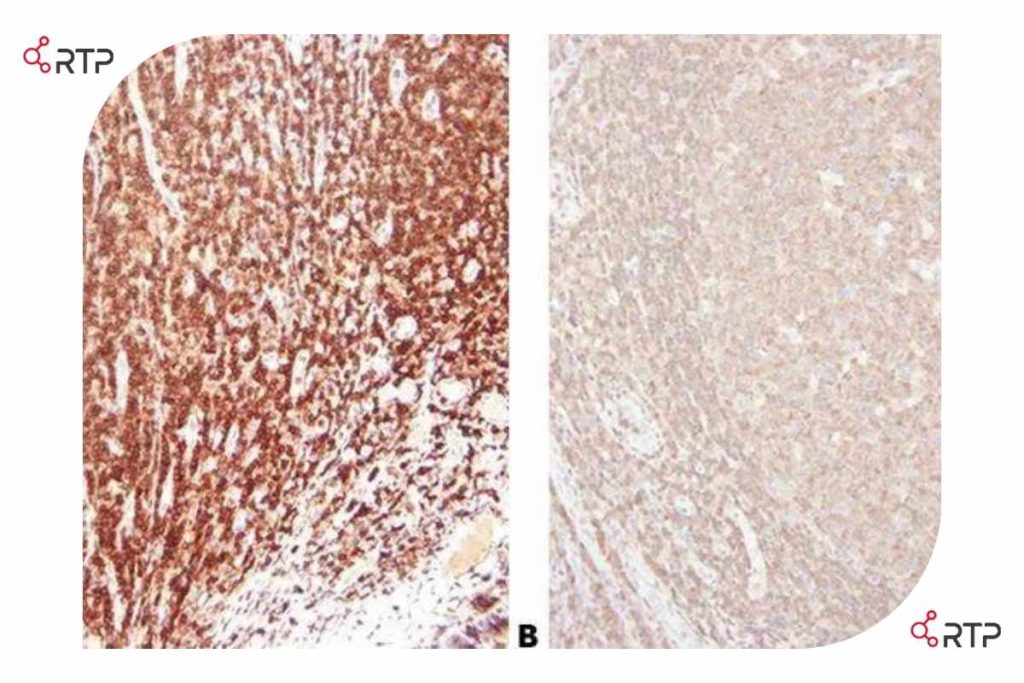
بخش های A و B بالا میکروگراف هایی هستند که دو انتهای یک اسلاید گرفته شده اند. در یک انتهای لام لکهگیری قوی (A) و در انتهای دیگر آن دیگر (B) رنگآمیزی ضعیف مشاهده می شود. این یک مثال واضح از تاثیر گرادیان بر روی رنگ پذیری بافت است(لوزه، CD45).
گام 5 – آنتی بادی را به دقت انتخاب کنید
با در نظر گفتن اساس این تکنیک و اهمیت حساسیت و اختصاصیت آنتی بادی ها در نتایج حاصله، انتخات آنتی بادی مناسب از اصلی ترین گام ها می باشد. توجه داشته باشید که آنتیبادیهایی که توسط تامینکنندگان مختلف فروخته میشوند، اغلب از یک منبع میآیند و برای فروش مجدد بستهبندی میشوند. یکی از مهمترین فاکتور ها در النتخاب آنتی بادی ، کلون آن است.
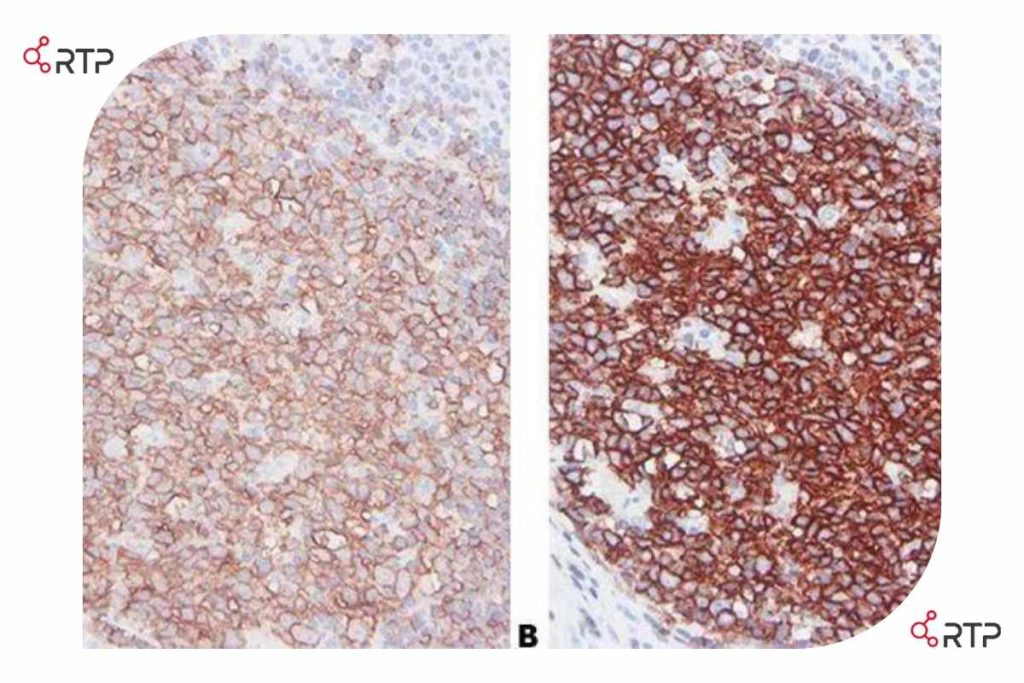
در این تصویر، بخشهایی از لوزه انسان نشان داده شده است که در آن مارکر CD20 در سلول های لنفوسیت B با آنتی بادی های مونوکلونال از برند های مختلف نشاندار شده اند. در همه موارد، روش های فیکس سازی بافت و رقت سازی یکسان انجام گرفته اند لیکن در کیفیت نتایج تفاوت آشکاری مشاهده می شود.
گام6 – برگه اطلاعات آنتی بادی را به دقت مطالعه کنید.
روش کار با آنتی بادی های مختلف با یکدیگر متفاوت است که می تواند در نتیجه آزمایش تاثیر شگرفی داشته باشد. از اینرو همیشه برگه مشخصات آنتی بادی را با دقت بررسی کنید تا از مناسب بودن روش روش خود بر اساس نوع آنتی بادی منتخب اطمینان حاصل نمایید. در نظر داشته باشید هنگام خرید دسته جدیدی از آنتی بادی ها، حتما برگه اطلاعات آن ها باید به روز شوند.
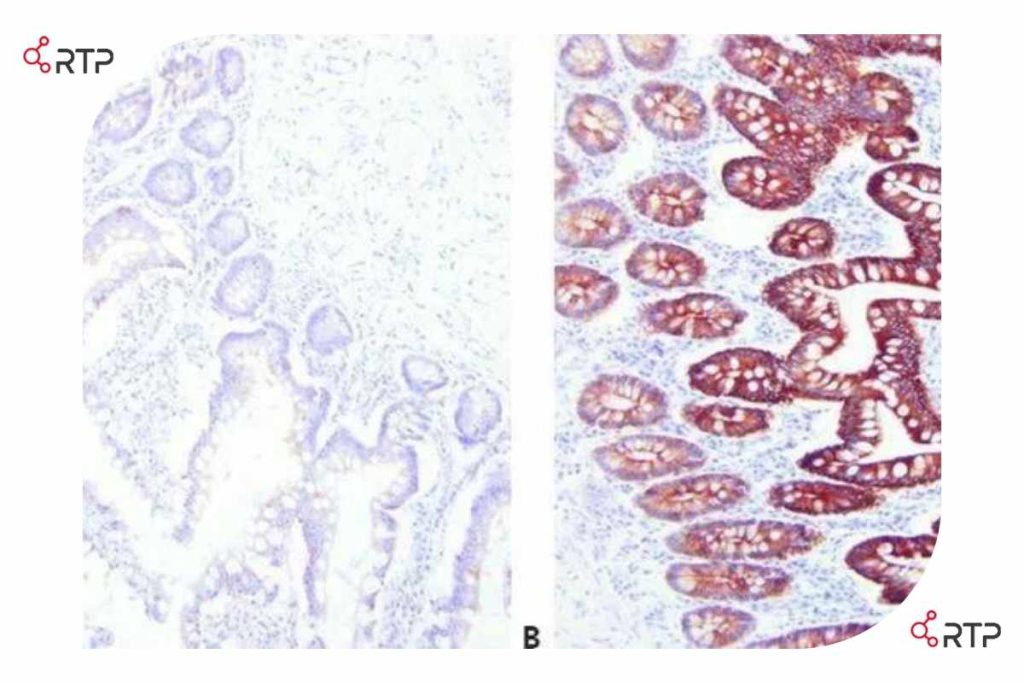
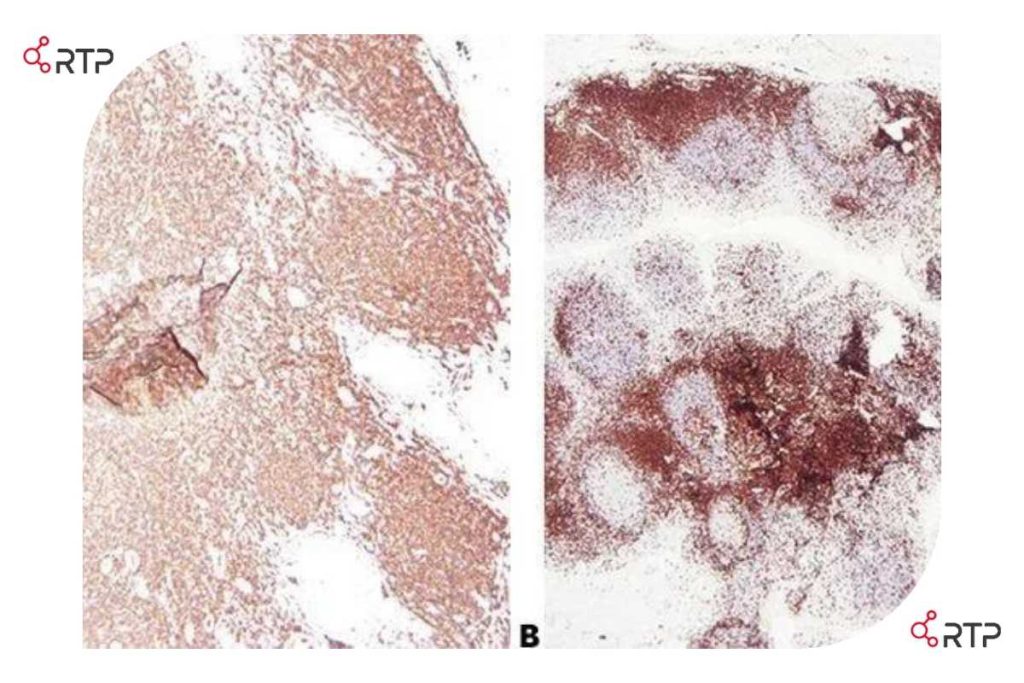
در تصویر فوق مقاطع مختلفی از بافت روده برای آنتی ژن سیتوکراتین AE1/AE3 رنگ آمیزی شده اند. برای هر مقطع از روش بازآرایی آنتی بادی متفاوتی استفاده شد. همانطور که مشاهده می کنید بخش A رنگآمیزی ضعیف و غیرقابل قبول را نشان میدهد، در حالی که در بخش B رنگآمیزی دقیق و قوی انجام گرفته است.
گام 7 – بهینه سازی روش های بازارایی
انتخاب روش و شرایط مناسب بازآرایی از جمله PH و معرف صحیح برای آنتی بادی اولیه منتخب، بافت مورد رنگ آمیزی و فیکس کردن بافت تاثیر مهمی در نتیجه ازمایش دارد.
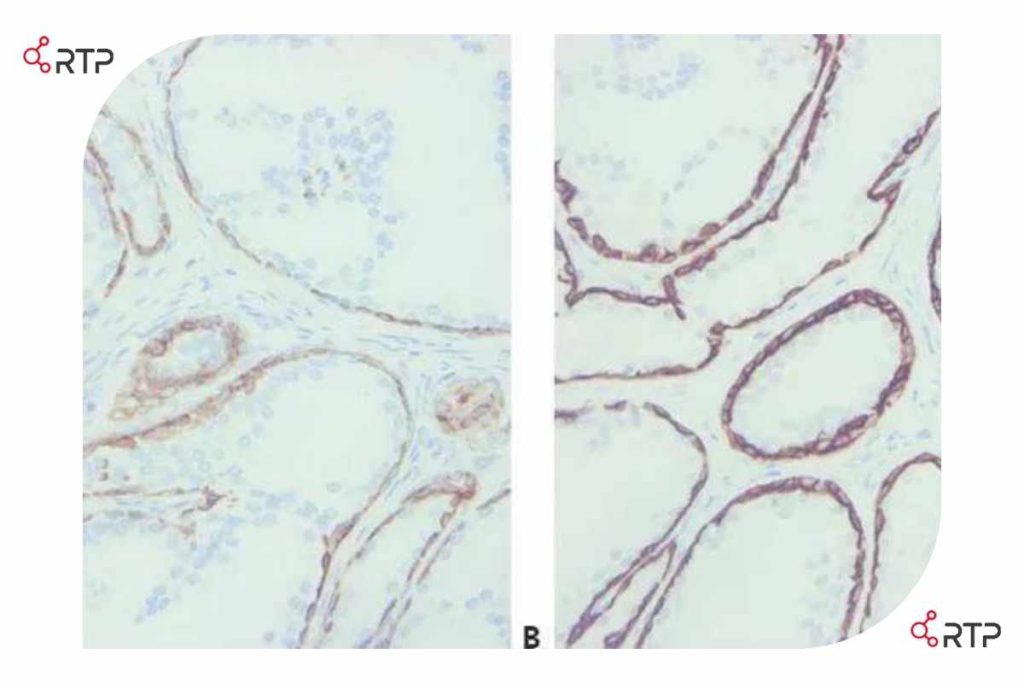
مقطعی از پروستات رنگ آمیزی شده برای سیتوکراتین 34βE12 : رنگ آمیزی مقطع A بسیار ضعیف بوده در حالی که در مقطع B قویتر و پر رنگ تر است. تنها تفاوت بین این دو در روش بازآرایی به کار رفته است.
گام 8 – واکنش های متقابل (Cross Reactivity) آنتی بادی را در نظر بگیرید
از هر گونه مشکل بالقوه در واکنش متقابل آنتی بادی آگاه باشید (برگ مشخصات را بخوانید).
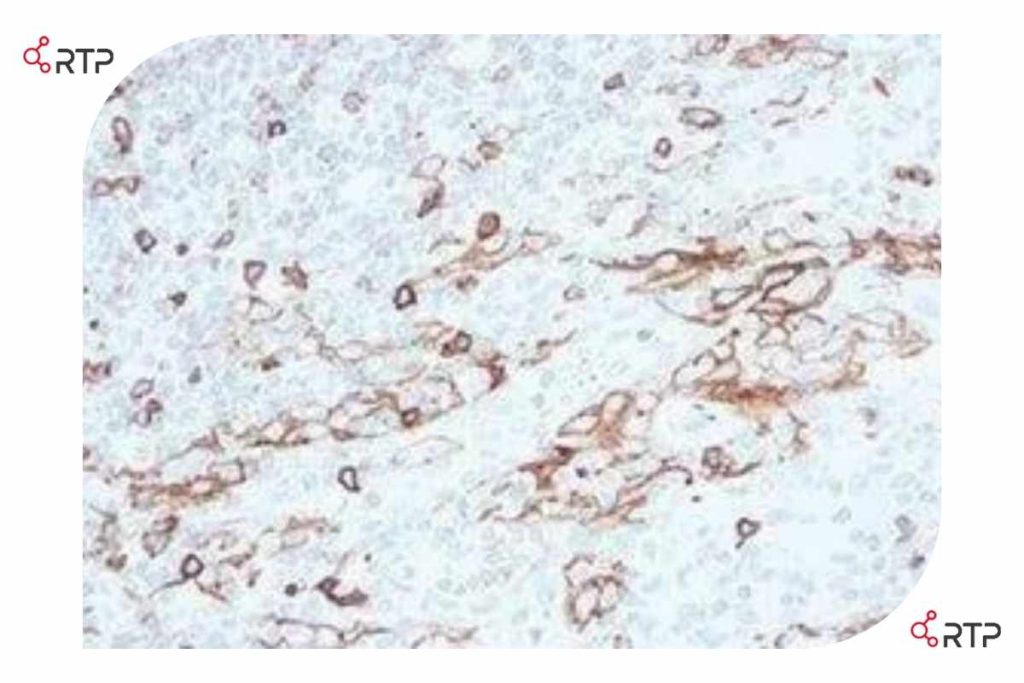
در تصویر بالا بافت لوزه برای مارکر CD5 ( یک نشانگر آختصاصی برای سلولهای لنفوسیت T) رنگ آمیزی شده است. این انتی بادی با کلون خاص (4C7) همزمان با سلولهای اپیتلیال در عمق بافت واکنش متقابل نشان میدهد.
گام 9 – عملکرد پراکسیداز داخل سلولی را مسدود کنید
برای سیستمهای تشخیص مبتنی بر پراکسیداز، همیشه از مرحله مسدودکننده پراکسیداز استفاده کنید.
رنگآمیزی غیر اختصاصی اغلب در گلبولهای قرمز، گرانولوسیتها، مونوسیتها و عضله دیده میشود که عمدتا به دلیل عملکرد آنزیم پراکسیداز داخل سلول و ایجاد تداخل با واکنش آنزیمی است.
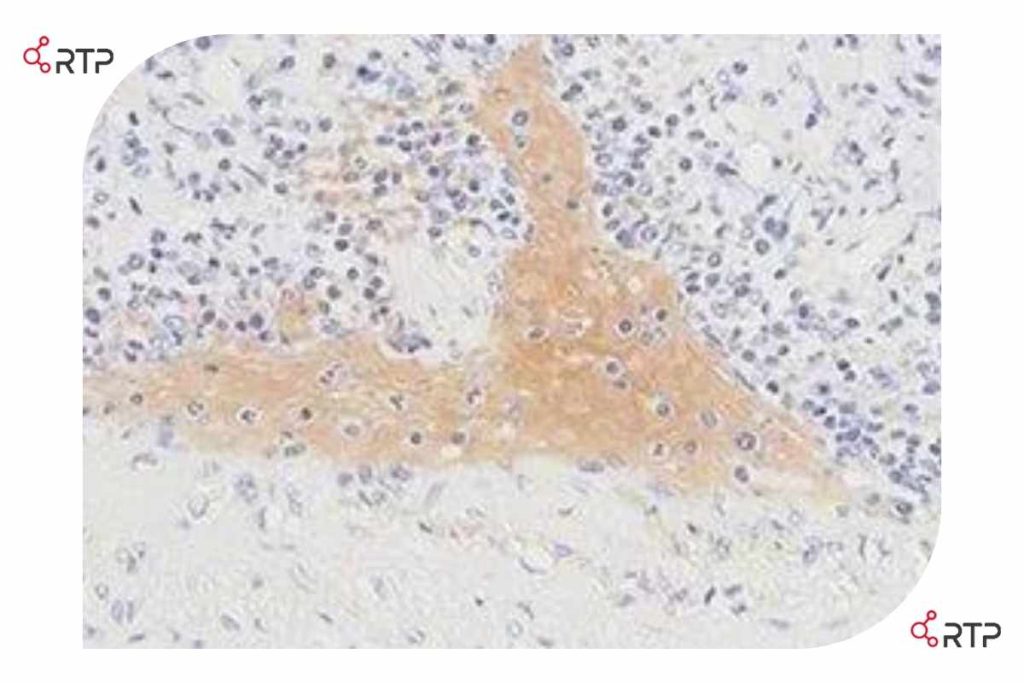
طحال به دلیل بلاک شدن ناکامل آنزیم پراکسیداز ، رنگآمیزی غیراختصاصی گلبولهای قرمز را نشان میدهد. در اینجا پراکسیداز طبیعی موجود در گلبولهای قرمز با کروموژن به صورت غیر اختصاصی با DAB واکنش نشان داده است.
مرحله 10 – از رنگآمیزی پسزمینه اجتناب کنید.
از معرف پروتئینی بلاک کننده مناسب جهت جلوگیری از رنگ پذیری پس زمینه استفاده کنید.

لوزه نرمال رنگ آمیزی شده برای زنجیره سبک کاپا که به دلیل استفاده از پروتئین بلاک کننده غیر موثر، لکه پذیری پس زمینه شدیدی را نشان می دهد.
گام 11 – از یک سیستم تشخیص و شناسایی مناسب استفاده کنید
یک سیستم تشخیص مناسب را انتخاب کنید که رنگآمیزی دقیق و خاص با حساسیت کافی را ارائه دهد.
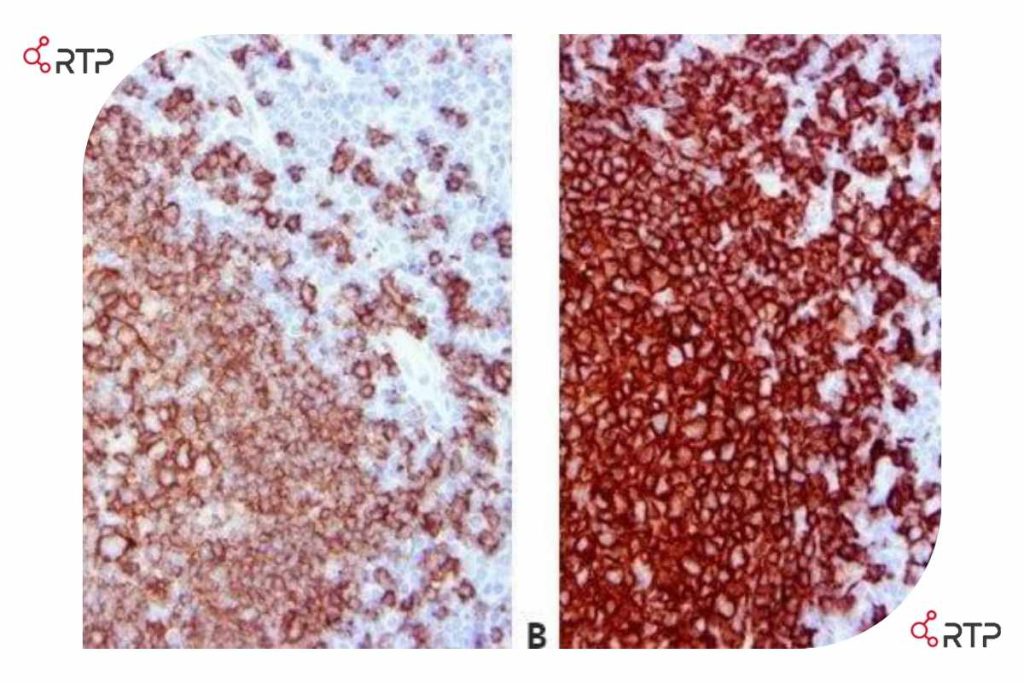
بخشهای A و B مقاطعی از یک بافت نمونه یکسان هستند که با سیستمهای تشخیص و شناسایی متفاوت رنگآمیزی شدهاند. به تفاوت شدت رنگ پذیری و اختصاصیت لکه های ایجاد شده توجه کنید(لوزه، CD20).
گام 12 – استاندارد سازی مراحل شست و شو
انجام مراحل استاندارد شست و شو در تمام طول آزمایش (از نظر مدت زمان، حجم مواد و تحوه ی غوطه ور سازی ) الزامی است. این یکپارچگی نتایج را تضمین می کند.
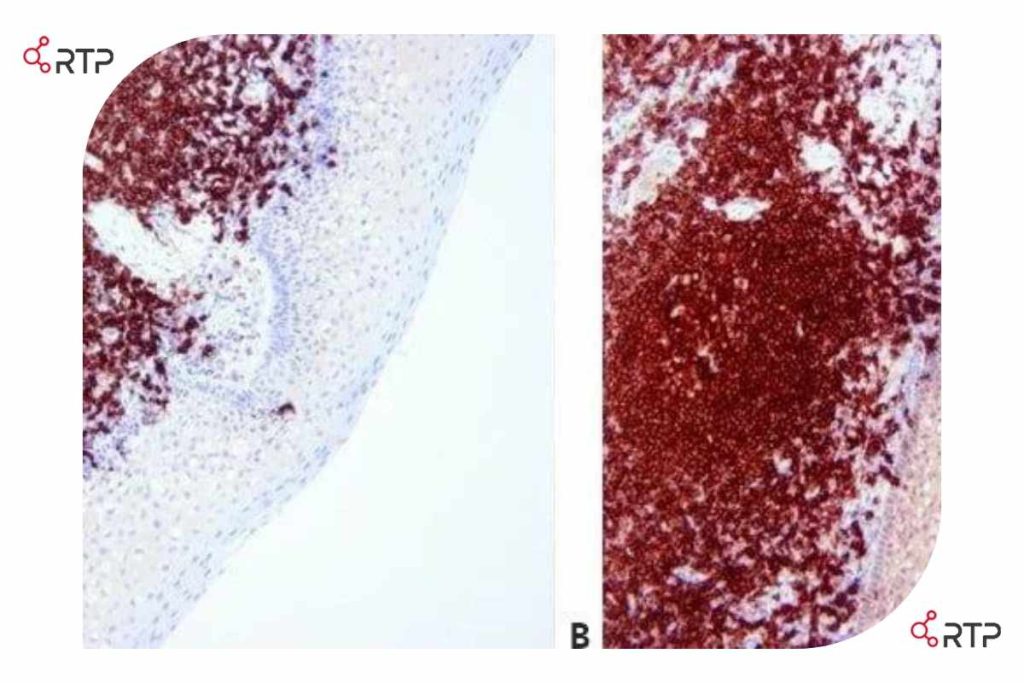
بخش های A و B مقاطعی از یک بافت نمونه یکسان هستند که به صورت دستی و با استفاده از معرف های مشابه رنگ آمیزی شده اند. به تفاوت سطح رنگآمیزی پس زمینه در اپیتلیوم توجه کنید. این احتمالاً به دلیل تفاوت در کارایی روش شستشوی مورد استفاده است. (لوزه، CD20)
گام 13 – بهینه سازی رنگ آمیزی بافت
انجام دقیق و مناسب رنگ پذیری هسته و تنظیم و استاندارد سازی می تواند سبب ایجاد رنگ آمیزی واضح بافت گردد.بهینه سازی رنگ آمیزی بافت سبب ایجاد تناقض واضح بین عناصر کروموژن و بافت پس زمینه می گردد. پس برای کروموژن مورد استفاده خود یک روش رنگ آمیزی مناسب انتخاب کنید.
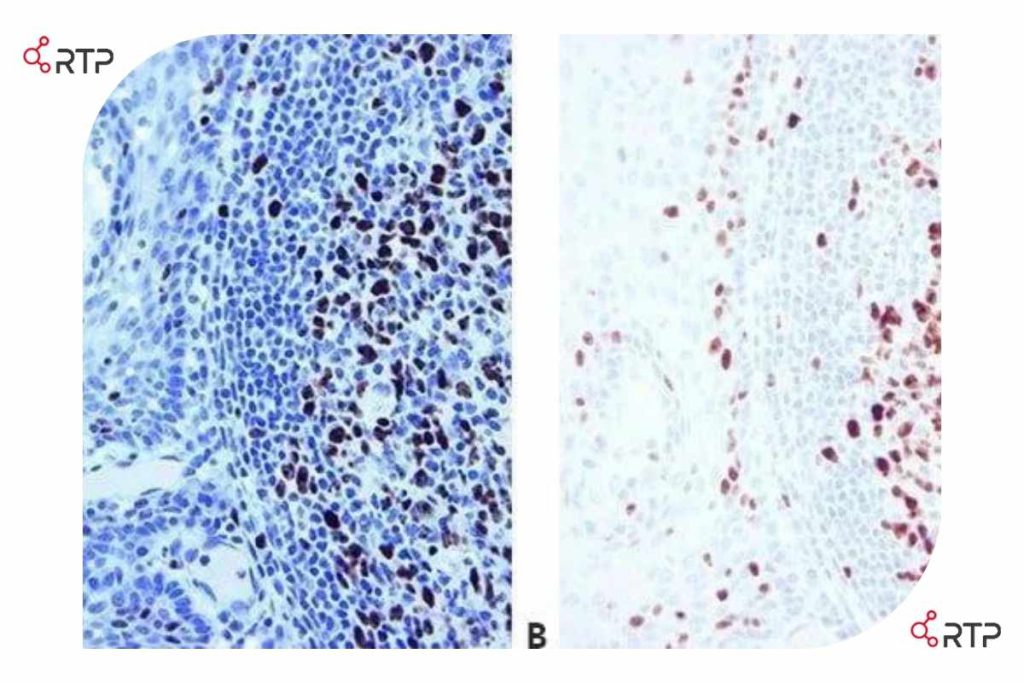
رنگ آمیزی لوزه برای Ki67 (مارکر هسته ای برای تکثیر سلولی). این دو بخش از یک نمونه یکسان هستند که سطوح متفاوتی از رنگ آمیزی با هماتوکسیلین را نشان می دهند. همانطور که مشاهده میشود در اسلاید A بدلیل رنگ آمیزی شدید بافت واکنش مثبت ضعیف را پنهان شده است لیکن در اسلاید B رنگآمیزی بهتر و دقیق تری را نشان میدهد.
گام 14 – از کنترل های مناسب استفاده کنید
همیشه از کنترل های مثبت و منفی مناسب استفاده کنید که تا از صحت ودقت نتایج اطمینان حاصل نمایید. کنترل های داخلی مثبت و منفی نیز مهم هستند و ابزاری عالی برای تضمین کیفیت در IHC ارائه می کنند.
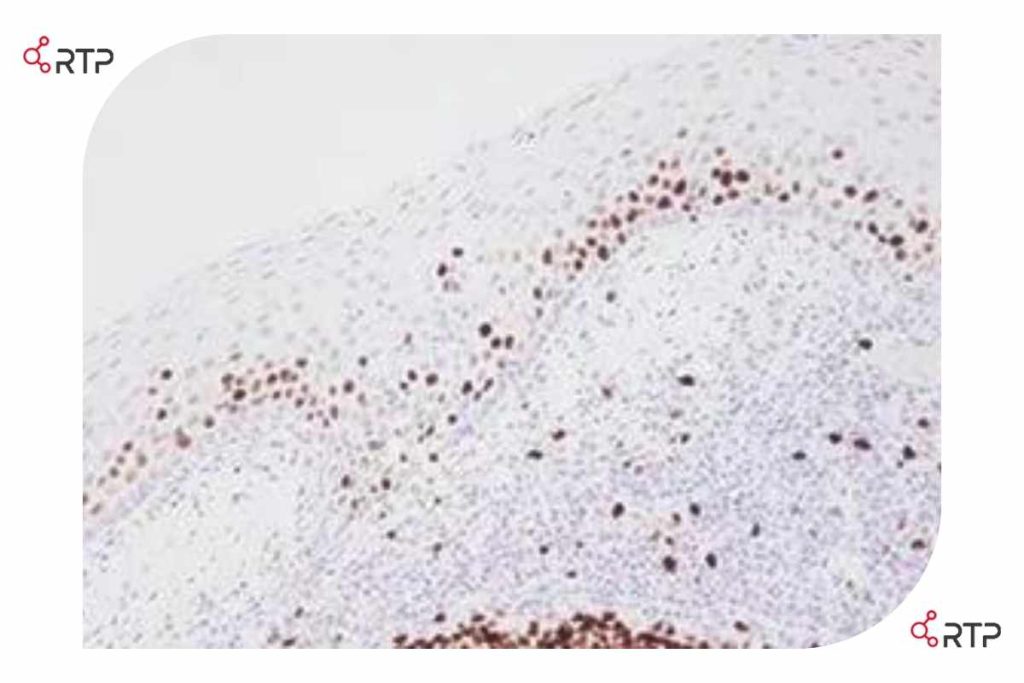
لوزه رنگ آمیزی شده برای Ki67. این اسلاید کنترل منفی بود و هسته ها نباید رنگ آمیزی شده باشند. در این تصویر اشتباها از آنتی بادی اولیه به جای معرف کنترل منفی بر روی این لام اعمال شده است.
گام 15 – نتایج را به دقت ارزیابی کنید
شما باید هنگام ارزیابی و تحلیل نتایج کاملا از آنچه به دنبال آن هستید آگاه باشید. در هنگام مشاهده ی نواحی رنگ آمیزی شده ی مورد آزمایش و کنترل ها باید بدانید به دنبال چه هستید و تنها به آنچه که میبینید اعتماد نکنید. در صورت مشاهده رنگ آمیزی در مقاطع آزمایشی، لکه ها راضی کننده فرض می شود.
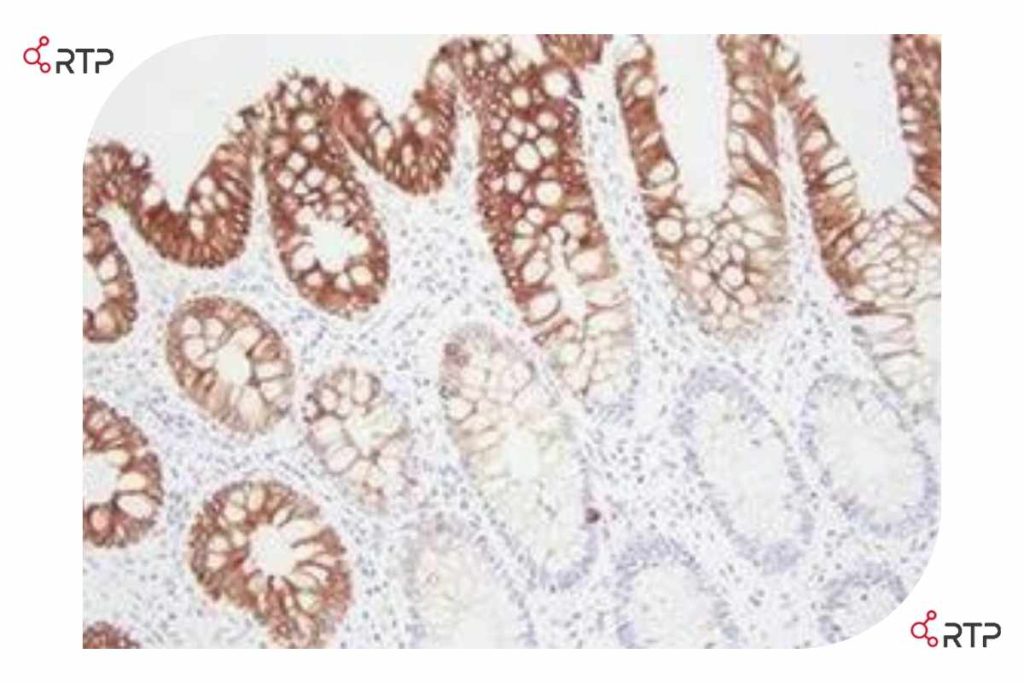
تصویر بالا بافت رنگ آمیزی شده اپیتلیوم روده برای مارکر را AE1/AE3 نشان میدهد. بر خلاف تصور رنگآمیزی ضعیفی برای مارکز نامبده در بافت اپیتلیوم کریپت اتفاق افتاده است. در بررسی، مشخص شد که CK20 به اشتباه به عنوان آنتی بادی اولیه مورد استفاده قرار گرفته است.
نکته ویژه: انتخاب آنتی بادی های مناسب
یک مرحله ساده اما مهم که گاها نادیده گرفته می شود، انتخاب آنتی بادی هایی است که برای ایمونوهیستوشیمی به کار می روند. این می تواند شما را از سردردهای بسیاری در طی انجام آزمایش نجات دهد. چندین نکته وجود دارد که باید در مورد آنتی بادی ها به خاطر داشت. آنتی بادی ای که در یک آزمایشگاه و در یک آزمایش دیگر به خوبی نتیجه داده است ممکن است الزاما برای آزمایشگاه شما بهینه نباشد. هر آنتی بادی ای می بایست با تکنیک منتخب رنگ آمیزی شما آزمایش و صحت عملکرد آن مورد ارزیابی قرار گیرد. آنتی بادی ها در طول زمان می توانند شدت رنگ خود را از دست بدهند. قرار گرفتن در معرض هوا و نور می تواند باعث ایجاد این مشکل شود.
آنتی بادی های کنستانتره (Concentrate) و آنتی بادی آماده برای استفاده RTU
هنگام انتخاب آنتی بادی ها، دو گزینه اصلی برای استفاده وجود دارد. یک فرمت کاملا غلیظ و کنستانتره یا یک فرمت آماده برای استفاده و آماده برای استفاده (از پیش رقیق شده) (RTU). کنستانتره ها جهت استفاده راحت تر هستند زیرا قیمت اولیه خرید پایین تری دارند و به طور کلی می توانند در هر سیستم رنگ آمیزی، هم خودکار و همدستی، با توجه به توصیه های سازنده استفاده شوند. رقت سازی از کنستانتره ها را می توان در راستای کاهش هزینه ها، زمان رنگ آمیزی و کیفیت بهینه سازی کرد. با توجه به گستره ی وسیع رقت سازی ، کنسانتره های یک آنتی بادی را می توان با توجه به شرایط آزمایش و یا نوع پروتکل انتخابی در حالت های متنوعی رقت سازی کرد. با این حال، کنسانتره ها به زمان آماده سازی و اعتبارسنجی نیاز دارند. از آنجایی که هیچ راه قطعی برای تعیین خواص و پایداری یک آنتی بادی رقیق شده بدون بررسی های دقیقی پیش از آزمایش وجود ندارد، این احتمال وجود دارد که کیفیت واکنش آنتی ژن-آنتی بادی و در نهایت کیفیت رنگ آمیزی رنگآمیزی را تحت تاثیر قرارداده و در نهایت بسیاری از مارکر ها شناسایی نشوند. از مزایای آنتی بادی های از پی رقیق شده RTU ها می توان به افزایش راندمان آزمایشگاهی، کنترل کیفیت بهتر و مدیریت راحت تر مواد و معرف ها اشاره کرد. در این مدل از آنتی بادی ها فرآیند رقیق سازی ، آماده سازی و اعتبارسنجی سنجش حذف می گردد. پیوستگی بین مراحل انجام کار با کاهش تغییرات در هر مرحله، بالاخص در رابطه با رنگ آمیزی های خودکار و سیستم های تشخیص مرتبط افزایش می باید. آنتی بادی های آماده برای استفاده با داشتن تعداد تست مشخص و تاریخ انقضای معین در بالابردن مدیریت مصرف معرف ها نقش موثری دارد. علاوه بر این، RTU ها می توانند با آسان سازی سازگاری آنتی بادی های جدید و کاهش چشمگیر اعتبارسنجی به رشد آزمایشگاه ها کمک کنند.
بیشتربدانید : استانداردسازی پیش از رنگ آمیزی بسیار مهم است!
هر پاتولوژیست، مدیر آزمایشگاه، یا هیستوتکنولوژیست به آسانی تایید می کند که آمادگی برای رنگ آمیزی IHC از لحظه ای شروع می شود که بافت مناسب داشته باشیم. در مقالات، شرایط بهینه جهت فیکس سازی بافت، پردازش و برش آن برای اطمینان از حفظ مورفولوژی و آنتیژنیسیته ذکر شده است. بهسازی در حفظ سازگاری برای کنترل صحیح این عوامل میتواند هنوز جای پیشرفت دارد. این پیشرفت ممکن است از آزمایشگاهی آغاز شود که محل جمعآوری، الحاق و آماده سازی نمونه ها می باشد.
الحاق خودکار، LISو زیرساخت ردیابی نمونه باید به خارج از آزمایشگاه و تا جراحی/نقطه بیوپسی نیز گسترش یابد که این خود منجر به ردیابی و کنترل تجهیزات آماده سازی استاندارد( ظروف “کنترل شده”، فیکساتورها) جهت پردازش بهینه مراحل پایین دست می شود. یک صنعت هنگام با این مطلب که ارزش این کار را نشان می دهد، آزمایشگاه آنالیز خون است که از ویال های جمع آوری کننده coat شده ی استاندارد با اطلاعات بارکد شده بیمار برای ردیابی و الحاق استفاده می کند. ارتباط دادن بین مراحل مختلف فیکس ساز بافت، پردازش آن و رنگآمیزی گزاره ای ارزشمند برای کنترل کیفیت تکنیک می باشد. آزمایشگاههایی که میتوانند شرایط فیکس سازی و پردازش بافت را نظارت و ثبت کنند و این موارد را با مرحله رنگ آمیزی هم مرتبط کنند می توانند تحت یک شرایط کنترلی سخت تر و دقیق تر تشخیص بیماری را گزارش کنند. استفاده مکرر از کنترلها برای تغییرپذیری پیش پردازش (به عنوان مثال، کنترل هر 100 اسلاید یک بار) ممکن است روش سنجش مناسبی برای بررسی عملکرد و تولرانس دستگاه رنگ آمیزی باشد. این روند عملکردی به عنوان صنعت ارتقا یافته ی تکنیک ihc تکامل می باید. با این حال، روش های کارآمد دیگری نیز وجود دارد که در پایه گذاری و حفظ نتایج با کیفیت و ثابت در تکنیک رنگ آمیزی IHC شناخته می شوند.
این نوشته تا چه اندازه برای شما مفید بود؟
روی ستاره ها کلیک کن تا امتیازت رو ثبت کنی!
میانگین امتیاز 2.5 / 5. تعداد رای دهندگان 2
هنوز کسی رای نداده اولین نفری باش که رای میده!